Как решать задачи по химии, готовые решения. Методика решения задач по химии. При решении задач необходимо руководствоваться несколькими простыми правилами Внимательно прочитать условие задачи Записать, что дано Перевести, если это необходимо, единицы физических величин в единицы системы СИ некоторые внесистемные единицы допускаются, например литры Записать, если это необходимо, уравнение реакции и расставить коэффициенты Решать задачу, используя понятие о количестве вещества, а не метод составления пропорций Записать ответ. В целях успешной подготовки по химии следует внимательно рассмотреть решения задач, приводимых в тексте, а также самостоятельно решить достаточное число их. Именно в процессе решения задач будут закреплены основные теоретические положения курса химии. Единица СИ количества вещества моль. Любая задача по химии решается через количество вещества. Необходимо помнить основную формулу. Основные формулы для решения задач по химии. Все, все основные задачи по химии решаются с помощью нескольких основных. Советы по самостоятельному решению задач по химии. Рекомендуем для тех, кто хочет сдать ЕГЭ по химии на высокий балл и не допустить самых разных ошибок при решении задач. Химические формулы 7, 8, 9, 10 и 11 классы. Таким образом, формула в химии это изображение состава вещества с помощью символов химических. Волшебный алгоритм решения задач по химии для ОГЭ и вузов. Или же в необходимую формулу подставить известную или. В пособии приведены все формулы по химии основные, уравнения. Основные физические величины и формулы для их вычисления, используемые при решении расчетных задач по химии. Целесообразно использовать для изучения химии в школе, для подготовки к ГИА и ЕГЭ. Минисправочник Формулы для решения задач по химии. Формулы Для Решения Задач По Химии' title='Формулы Для Решения Задач По Химии' />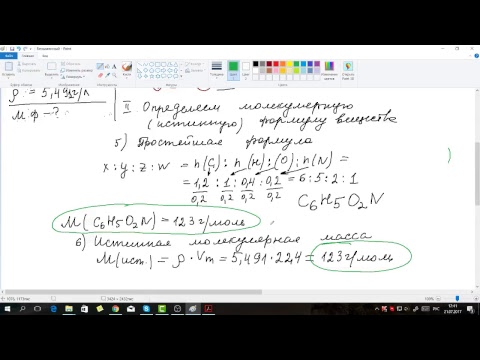 Решать задачи необходимо на протяжении всего времени изучения химии и подготовки к экзамену. Вы можете использовать задачи на этой странице, а можете скачать хороший сборник задач и упражнений с решением типовых и усложненных задач М. Лебедева, И. Анкудимова скачать. D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/583233/4.gif' alt='Формулы Для Решения Задач По Химии' title='Формулы Для Решения Задач По Химии' />Моль, молярная масса. Молярная масса это отношение массы вещества к количеству вещества, т. Мх mx. Единица СИ молярной массы кгмоль, однако обычно используется единица гмоль. Единица массы г, кг. Единица СИ количества вещества моль. Любая задача по химии решается через количество вещества. Необходимо помнить основную формулу. Определите массу иодида натрия Na. I количеством вещества 0,6 моль. Формулы Для Решения Задач По Химии' title='Формулы Для Решения Задач По Химии' />Дано. Молярная масса иодида натрия составляет MNa. I MNa MI 2. Определяем массу Na. I mNa. I. Определите количество вещества атомного бора, содержащегося в тетраборате натрия Na. B4. O7 массой 4. 0,4 г. Дано mNa. 2B4. O74. Найти . Молярная масса тетрабората натрия составляет 2. Определяем количество вещества Na. B4. O7. Тогда количество вещества атомного бора равно. Массовая доля безразмерная величина. Е выражают в долях от единицы или в процентах. Например, массовая доля атомного кислорода составляет 0,4. Массовая доля атомного хлора в хлориде натрия составляет 0,6. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария Ba. Cl. 2. Отсюда можно определить массу воды, содержащейся в Ba. Cl. 2. Из образца горной породы массой 2. Ag. 2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце. Дано mAg 5,4 г m 2. Найти. Определяем количество вещества аргентита. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 2. Дано. Массы калия, марганца и кислорода составят m К m. При сгорании 1,3 г вещества образовалось 4,4 г оксида углерода IV и 0,9 г воды. Найти молекулярную формулу вещества, если его плотность по водороду равна 3. Дано mв ва 1,3 г mСО24,4 г mН2. О0,9 г ДН2 3. Найти формулу вещества. Решение Предположим, что искомое вещество содержит углерод, водород и кислород, т. Тогда необходимо найти количества веществ СО2 и Н2. О, чтобы определить количества веществ атомарных углерода, водорода и кислорода. Определим теперь его молекулярную массу, исходя из данной в условии задачи плотности вещества по водороду. Мв ва 2. Отсюда х 6. Следовательно, формула вещества С6. Н6 бензол. Молярный объем газов. Законы идеальных газов. Объемная доля. Молярный объем газа равен отношению объема газа к количеству вещества этого газа, т. Vm VX. Молярный объем газов при нормальных условиях нормальном давлении рн 1. Сборник Военных Маршей на этой странице. Па. Объемная доля безразмерная величина, е выражают в долях от единицы или в процентах. Какой объем займет при температуре 2. С и давлении 2. 50 к. Па аммиак массой 5. Дано mNH35. 1 г p2. Па t2. 0o. C. Найти VNH3 Решение определяем количество вещества аммиака. Определите объем, который займет при нормальных условиях газовая смесь, содержащая водород, массой 1,4 г и азот, массой 5,6 г. Дано mN25,6 г mH21,4 н. Найти VсмесиРешение находим количества вещества водорода и азота. Однако в реальных химических процессах из за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции или массовая доля выхода это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т. Какую массу фосфора надо сжечь для получения оксида фосфора V массой 7,1 гДано mP2. O57,1 г. Найти mР Решение записываем уравнение реакции горения фосфора и расставляем стехиометрические коэффициенты. P 5. O2 2. P2. O5. Определяем количество вещества P2. O5, получившегося в реакции. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этомДано mMg6 г mZn6,5 г н. Найти VH2 Решение записываем уравнения реакции взаимодействия магния и цинка с соляной кислотой и расставляем стехиометрические коэффициенты. Zn 2 HCl Zn. Cl. H2. При пропускании сероводорода объемом 2,8 л нормальные условия через избыток раствора сульфата меди II образовался осадок массой 1. Определите выход продукта реакции. Дано VH2. S2,8 л mосадка 1. Найти. Значит можно найти теоретическую массу Сu. S. mСu. S. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г Какой газ останется в избытке Определите массу избытка. Дано mHCl7,3 г mNH35,1 г. Найти mNH4. Cl Рассчитываем количества вещества хлороводорода и аммиака и определяем, какой газ находится в избытке. Из уравнения реакции следует, что. Определяем массу хлорида аммония. NH4. Cl. Рассчитаем массу избытка аммиака. NH3. Технический карбид кальция массой 2. Отсюда мы можем найти массу чистого карбида кальция без примесей. Са. C2. Массовая доля компонента раствора. В бензоле объемом 1. Плотность бензола равна 0,8. Определите массовую долю серы в растворе. Дано VC6. H6 1. S 1,8 г. Определяем массу бензола. С6. C6. В воде массой 4. Fe. SO4. Определите массовую долю сульфата железа II в полученном растворе. Дано mH2. O4. Fe. SO4. Для этого рассчитаем количество вещества Fe. SO4. Рассчитаем массу Fe. SO4 mFe. SO4. Определите массовую долю йодистого метила в растворе. Ответ 2. 8,4. Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 1. 3,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 1. КОН с массовой долей 2. Плотность раствора КОН равна 1,2. Определите формулу спирта. Ответ бутанол. Газ, полученный при взаимодействии 9,5. Na. OH плотностью 1,2. Определите массовые доли растворенных веществ. Ответ 1. 2,5 Na. OH 6,4. Na. NO3 5,2. Na. NO2. Определите объем выделившихся газов при взрыве 1. Ответ 7,1. 5 л. Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода IV объемом 6,7. Плотность паров исходного вещества по водороду равна 4. Определите формулу вещества. Ответ С6. Н1. 4. Однако, вряд ли такое чудо прокатит и во время сдачи сессии. Чтобы не оплошать, давайте выяснять, что же необходимо, чтобы таки начать самому выполнять решение практических задач по химии. Химия глубоко системная наука. Что в школе 8 9 класс, что в вузе схема решения задач по химии примерно одинакова. Существует определенный набор определенных химических веществ. Каждое из этих веществ обладает определенными характеристиками. Понимая систему этой науки в целом, а также систему и суть основных веществ, даже будучи гуманитарием до глубины души вы сможете выучить и понять правила решения задач по химии. А для этого вам понадобятся Необходимая мотивация и готовность работать. Если есть цель и трудолюбие, то все у вас получится, поверьте Хотя бы базовое знание теории таблица Менделеева, минимальный глоссарий, знание простейших формул соединений и т. Внимательность. Часто многие проблемы в решении задач химии студенты испытывают из за банальной невнимательности. Очень тщательно читайте условие задачи, спишите все краткие данные и определите, что же все таки нужно найти. А дальше все просто следуем стандартному алгоритму действий. Волшебный алгоритм решения задач по химии для ОГЭ и вузовА вот и она волшебная схема решения стандартных задач по химии, благодаря которой вы сможете ответить на экзамене хотя бы на минимальную проходную оценку Для начала запишите уравнение реакции если требуется. При этом важно не забывать о расстановке коэффициентов. Попытайтесь определить, как найти неизвестные данные, сколько действий для этого понадобится, нужно ли для этого использовать таблицу Менделеева например, чтобы выяснить молекулярную массу или прочие справочные данные. Теперь, если нужно, самое время составить пропорцию или применить понятие количества вещества. Или же в необходимую формулу подставить известную или найденную величину. Если в задаче нужно использовать формулу, обращайте внимание на единицы измерений. Нередко требуется их перевод в систему СИ. Когда решение найдено и вы расслабились, не спешите перечитайте условие задачи еще раз. Бывает, что студент начал не с того. В тоге все это время он занимался поиском совершенно не того, что требуется. А вот еще несколько примеров решения задач по химии, которые вы вполне можете использовать в качестве примера и тщательно проанализировать На самом деле, решение задач по химии дело не такое уж и сложное. Конечно, нам легко говорить, ведь за плечами наших авторов многолетний опыт решения не только простейших, но и мега супер бупер крутых по сложности задач. И если вам попалась одна из таких, не стесняйтесь обращаться за помощью, здесь вам никто никогда не откажет Вы можете заказать эссе или заказать доклад, для этого нужно только оформить заявку. Кстати, чуть ниже вы можете посмотреть краткое видео с наглядными примерами решения задач по химии.
Решать задачи необходимо на протяжении всего времени изучения химии и подготовки к экзамену. Вы можете использовать задачи на этой странице, а можете скачать хороший сборник задач и упражнений с решением типовых и усложненных задач М. Лебедева, И. Анкудимова скачать. D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/583233/4.gif' alt='Формулы Для Решения Задач По Химии' title='Формулы Для Решения Задач По Химии' />Моль, молярная масса. Молярная масса это отношение массы вещества к количеству вещества, т. Мх mx. Единица СИ молярной массы кгмоль, однако обычно используется единица гмоль. Единица массы г, кг. Единица СИ количества вещества моль. Любая задача по химии решается через количество вещества. Необходимо помнить основную формулу. Определите массу иодида натрия Na. I количеством вещества 0,6 моль. Формулы Для Решения Задач По Химии' title='Формулы Для Решения Задач По Химии' />Дано. Молярная масса иодида натрия составляет MNa. I MNa MI 2. Определяем массу Na. I mNa. I. Определите количество вещества атомного бора, содержащегося в тетраборате натрия Na. B4. O7 массой 4. 0,4 г. Дано mNa. 2B4. O74. Найти . Молярная масса тетрабората натрия составляет 2. Определяем количество вещества Na. B4. O7. Тогда количество вещества атомного бора равно. Массовая доля безразмерная величина. Е выражают в долях от единицы или в процентах. Например, массовая доля атомного кислорода составляет 0,4. Массовая доля атомного хлора в хлориде натрия составляет 0,6. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария Ba. Cl. 2. Отсюда можно определить массу воды, содержащейся в Ba. Cl. 2. Из образца горной породы массой 2. Ag. 2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце. Дано mAg 5,4 г m 2. Найти. Определяем количество вещества аргентита. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 2. Дано. Массы калия, марганца и кислорода составят m К m. При сгорании 1,3 г вещества образовалось 4,4 г оксида углерода IV и 0,9 г воды. Найти молекулярную формулу вещества, если его плотность по водороду равна 3. Дано mв ва 1,3 г mСО24,4 г mН2. О0,9 г ДН2 3. Найти формулу вещества. Решение Предположим, что искомое вещество содержит углерод, водород и кислород, т. Тогда необходимо найти количества веществ СО2 и Н2. О, чтобы определить количества веществ атомарных углерода, водорода и кислорода. Определим теперь его молекулярную массу, исходя из данной в условии задачи плотности вещества по водороду. Мв ва 2. Отсюда х 6. Следовательно, формула вещества С6. Н6 бензол. Молярный объем газов. Законы идеальных газов. Объемная доля. Молярный объем газа равен отношению объема газа к количеству вещества этого газа, т. Vm VX. Молярный объем газов при нормальных условиях нормальном давлении рн 1. Сборник Военных Маршей на этой странице. Па. Объемная доля безразмерная величина, е выражают в долях от единицы или в процентах. Какой объем займет при температуре 2. С и давлении 2. 50 к. Па аммиак массой 5. Дано mNH35. 1 г p2. Па t2. 0o. C. Найти VNH3 Решение определяем количество вещества аммиака. Определите объем, который займет при нормальных условиях газовая смесь, содержащая водород, массой 1,4 г и азот, массой 5,6 г. Дано mN25,6 г mH21,4 н. Найти VсмесиРешение находим количества вещества водорода и азота. Однако в реальных химических процессах из за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции или массовая доля выхода это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т. Какую массу фосфора надо сжечь для получения оксида фосфора V массой 7,1 гДано mP2. O57,1 г. Найти mР Решение записываем уравнение реакции горения фосфора и расставляем стехиометрические коэффициенты. P 5. O2 2. P2. O5. Определяем количество вещества P2. O5, получившегося в реакции. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этомДано mMg6 г mZn6,5 г н. Найти VH2 Решение записываем уравнения реакции взаимодействия магния и цинка с соляной кислотой и расставляем стехиометрические коэффициенты. Zn 2 HCl Zn. Cl. H2. При пропускании сероводорода объемом 2,8 л нормальные условия через избыток раствора сульфата меди II образовался осадок массой 1. Определите выход продукта реакции. Дано VH2. S2,8 л mосадка 1. Найти. Значит можно найти теоретическую массу Сu. S. mСu. S. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г Какой газ останется в избытке Определите массу избытка. Дано mHCl7,3 г mNH35,1 г. Найти mNH4. Cl Рассчитываем количества вещества хлороводорода и аммиака и определяем, какой газ находится в избытке. Из уравнения реакции следует, что. Определяем массу хлорида аммония. NH4. Cl. Рассчитаем массу избытка аммиака. NH3. Технический карбид кальция массой 2. Отсюда мы можем найти массу чистого карбида кальция без примесей. Са. C2. Массовая доля компонента раствора. В бензоле объемом 1. Плотность бензола равна 0,8. Определите массовую долю серы в растворе. Дано VC6. H6 1. S 1,8 г. Определяем массу бензола. С6. C6. В воде массой 4. Fe. SO4. Определите массовую долю сульфата железа II в полученном растворе. Дано mH2. O4. Fe. SO4. Для этого рассчитаем количество вещества Fe. SO4. Рассчитаем массу Fe. SO4 mFe. SO4. Определите массовую долю йодистого метила в растворе. Ответ 2. 8,4. Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 1. 3,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 1. КОН с массовой долей 2. Плотность раствора КОН равна 1,2. Определите формулу спирта. Ответ бутанол. Газ, полученный при взаимодействии 9,5. Na. OH плотностью 1,2. Определите массовые доли растворенных веществ. Ответ 1. 2,5 Na. OH 6,4. Na. NO3 5,2. Na. NO2. Определите объем выделившихся газов при взрыве 1. Ответ 7,1. 5 л. Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода IV объемом 6,7. Плотность паров исходного вещества по водороду равна 4. Определите формулу вещества. Ответ С6. Н1. 4. Однако, вряд ли такое чудо прокатит и во время сдачи сессии. Чтобы не оплошать, давайте выяснять, что же необходимо, чтобы таки начать самому выполнять решение практических задач по химии. Химия глубоко системная наука. Что в школе 8 9 класс, что в вузе схема решения задач по химии примерно одинакова. Существует определенный набор определенных химических веществ. Каждое из этих веществ обладает определенными характеристиками. Понимая систему этой науки в целом, а также систему и суть основных веществ, даже будучи гуманитарием до глубины души вы сможете выучить и понять правила решения задач по химии. А для этого вам понадобятся Необходимая мотивация и готовность работать. Если есть цель и трудолюбие, то все у вас получится, поверьте Хотя бы базовое знание теории таблица Менделеева, минимальный глоссарий, знание простейших формул соединений и т. Внимательность. Часто многие проблемы в решении задач химии студенты испытывают из за банальной невнимательности. Очень тщательно читайте условие задачи, спишите все краткие данные и определите, что же все таки нужно найти. А дальше все просто следуем стандартному алгоритму действий. Волшебный алгоритм решения задач по химии для ОГЭ и вузовА вот и она волшебная схема решения стандартных задач по химии, благодаря которой вы сможете ответить на экзамене хотя бы на минимальную проходную оценку Для начала запишите уравнение реакции если требуется. При этом важно не забывать о расстановке коэффициентов. Попытайтесь определить, как найти неизвестные данные, сколько действий для этого понадобится, нужно ли для этого использовать таблицу Менделеева например, чтобы выяснить молекулярную массу или прочие справочные данные. Теперь, если нужно, самое время составить пропорцию или применить понятие количества вещества. Или же в необходимую формулу подставить известную или найденную величину. Если в задаче нужно использовать формулу, обращайте внимание на единицы измерений. Нередко требуется их перевод в систему СИ. Когда решение найдено и вы расслабились, не спешите перечитайте условие задачи еще раз. Бывает, что студент начал не с того. В тоге все это время он занимался поиском совершенно не того, что требуется. А вот еще несколько примеров решения задач по химии, которые вы вполне можете использовать в качестве примера и тщательно проанализировать На самом деле, решение задач по химии дело не такое уж и сложное. Конечно, нам легко говорить, ведь за плечами наших авторов многолетний опыт решения не только простейших, но и мега супер бупер крутых по сложности задач. И если вам попалась одна из таких, не стесняйтесь обращаться за помощью, здесь вам никто никогда не откажет Вы можете заказать эссе или заказать доклад, для этого нужно только оформить заявку. Кстати, чуть ниже вы можете посмотреть краткое видео с наглядными примерами решения задач по химии.
Страницы
- Книга Мюллер И Сын
- Фаза 21 Инструкция
- Драйвер На Картридер Для Lenovo B570
- Как Вычисляют Запрещенные Моды Wot
- Отношения С Окружающими Аркадия Кирсанова
- Программа Для Караоке Encore Professional
- Учебник Озерской По Мезотерапии
- Великие Нации Никогда Не Беднеют Из-За Расточительства Эссе
- Таблицу С Цифрами До 100
- Драйвера Для Колонки Defender Spk 330 Usb
- Трудовое Право Европейского Союза Кашкин С.Ю